|
李金洋,敖永華,劉慶玉
(沈陽農業大學工程學院,沈陽110161)
摘要:沼氣是一種混合氣體,其中含有的硫化氫是一種有害氣體,使用前必須進行脫除。工業上脫硫的技術已經比較成熟,主要可分為濕法脫硫和干法脫硫。目前,這些方法在沼氣脫硫中應用較多,但是還存在著許多缺點。生物脫硫通過微生物的作用,將硫化物轉化成單質硫予以脫除,具有運行成本低和無二次污染的特點,有著極好的發展前景。
0引言
沼氣是一種可再生能源,在目前能源短缺的情況下日益受到人們的重視。通常沼氣的氣體的組成為甲烷(60%~70%)和二氧化碳(30%~40%),另外還含有少量的硫化氫等氣體。硫化氫是一種劇毒的有害氣體,對管道、燃燒器和儀器儀表等有強烈的腐蝕作用;燃燒后硫化氫生成二氧化硫,污染環境,并影響人的身體健康。我國環保標準嚴格規定:利用沼氣能源時,沼氣氣體中硫化氫含量不得超過20mg/m3。沼氣中的硫化氫質量濃度一般為1~12g/m3,遠遠高于我國環保標準的規定。所以,硫化氫的脫除成為沼氣使用過程中必不可少的一個環節。
1傳統的脫硫方法
1.1濕法脫硫
濕法脫硫是利用特定的溶劑與氣體逆流接觸而脫除其中的硫化氫,溶劑通過再生后重新進行吸收。根據吸收機理的不同,又分為化學吸收法、物理吸收法、物理化學吸收法以及濕式氧化法。濕法脫硫流程復雜,投資大,適合于氣體處理量大和硫化氫含量高的場合。其中,常用于沼氣脫硫的方法有萘醌吸收法和氨水法等。
1.1.1萘醌吸收法
吸收液呈堿性,能吸收酸性氣體,而且由于弱酸性的緩沖作用,在吸收酸性氣體時,pH值不會很快發生變化,保證了系統操作的穩定性。此外,碳酸鈉溶液吸收H2S比吸收CO2快。由于在沼氣中這兩種酸性氣體同時存在,所以可以部分地選擇吸收H2S。該法已成功地用于從氣體中脫除大量CO2,也可用來脫除含CO2和硫化氫的天然氣及沼氣中的酸性氣體。
此溶液對H2S吸收的化學反應方程式為
Na2CO3+H2S=NaHCO3+NaHS
許寧和朱延美[1]等針對沼氣的組成,對萘醌吸收液進行了改進研究,確定了用于沼氣中硫化氫吸收液的適宜配方,使脫硫率達到了99%~99.5%。
該方法的主要優點是設備簡單且經濟;主要缺點是一部分碳酸鈉變成了重碳酸鈉而導致吸收效率降低,一部分變成硫酸鹽而被消耗。
1.1.2氨水法
硫化氫是酸性氣體,當用堿性的氨水吸收硫化氫時,便發生中和反應,即
H2S+NH4OH=NH4HS+H2O
第1步是物理溶解過程,氣體中硫化氫溶解于氨水;第2步是化學吸收過程,溶解的硫化氫和氫氧化銨起中和反應。再生方法是往含硫氫化銨的溶液中吹入空氣,以產生吸收反應的逆過程,使硫化氫氣體解析出來。解析后的氫氧化銨溶液經補充新鮮氨水后,繼續用于吸收;再生時產生的硫化氫必須進行二次加工,避免造成環境污染。如采用氨水液相催化脫硫,借助溶液對苯二酚的氧化作用,使硫化氫氧化成元素硫而被分離,同時溶液獲得再生。生成的硫顆粒由于比較細,不易過濾回收,對填料和器壁附著力強,塔內易形成硫堵,影響生產。
氨法采用氨水作吸收劑,對設備腐蝕較大,且污染環境,但在處理焦爐煤氣時因可以利用焦化廠自產的堿源而具有經濟上的優勢。農業部成都沼氣科學研究所研究利用氨水脫除沼氣中CO2和H2S的技術[2],H2S平均脫除率達到了99.9%。
1.2干法脫硫
干法脫硫常用于低含硫氣體的處理,常用的方法有膜分離法、分子篩法、變壓吸附(PSA)法、不可再生的固定床吸附法和低溫分離法。沼氣脫硫常用不可再生的固定床吸附法,不可再生的固定床吸附法有很多,從物系上大致可分為鐵系、鋅系、活性炭、活性氧化鋁和硅膠等,常用于低含硫氣體的精脫過程。
氧化鐵是一種古老的脫硫劑,通常稱其為海綿鐵,其脫硫機理是先與H2S反應生成硫化鐵,再將硫化鐵氧化成氧化鐵。它可脫除氣體中10-6級的H2S,已經有多種改良方法獲得了工業應用。
干法存在操作不連續、更換脫硫劑勞動強度大以及裝置占地面積大等缺點。為此,牛克勝和孫嚴聲[3]在脫硫的同時通過自動控制系統連續定量地投加空氣,實現了脫硫劑的連續還原再生[1]。
目前,國內脫硫技術已比較成熟,脫硫方法及脫硫工藝眾多,但是都存在著以下缺點:干法脫硫效率不高,脫硫劑再生困難,硫容相對較低,主要適用于精細脫硫;濕法脫硫處理量大,脫硫效率高,可連續操作,但投資運行費用也高,沼氣利用一般用戶難以承受。隨著環保法規的日趨嚴格,開發高效、低投入、資源化和無二次污染的技術已成為脫硫技術發展的主流。一些新的脫硫方法(如微生物分解法、臭氧氧化法、二氧化硫法、電化學法和微波法)正日益引起人們的重視,其中生物脫硫具有少污染、低能耗和高效率等特點,成為研究的熱點。
2生物脫硫
生物脫硫是利用微生物的代謝作用將沼氣中的硫化物轉化為單質硫或硫酸鹽。其過程可分為3個階段:一是H2S氣體的溶解過程,即由氣相轉移到液相;二是溶解后的H2S被微生物吸收,轉移至微生物的體內;三是進人微生物細胞內的H2S作為營養被微生物分解、轉化和利用,從而達到去除H2S的目的。
根據微生物的活動類型,能夠轉化硫化物的微生物有3種,即光合細菌、反硝化細菌和無色硫細菌。其中,反硝化細菌在氧化硫化物的過程中需要硝酸鹽,因此該技術應用受到一定的限制。
2.1光合細菌
光合細菌也稱有氧化硫細菌,為光能營養細菌,能夠利用光能而生長,廣泛分布于自然環境中。它們在自然界碳、氮、硫等元素的循環中起著重要的作用,可以從光中獲得能量。光合細菌利用細菌葉綠素固定光能,以分子氫、還原性硫化物或有機物為外源電子供體,而不是以水分子為外源電子供體。因此,細菌的光合作用與植物和藻類不同,是一個厭氧過程,不產生氧氣。在光合作用過程中,不同的光合細菌以不同的硫化合物(如硫化物、硫單質、亞硫酸鹽及硫代硫化物)作為電子供體同化CO2。某些光合細菌還可利用硫醇類物質。光合細菌利用硫化物時,首先將硫化物氧化為單質硫,沉積于細胞內(如紫色硫細菌)或細胞外(如紫色外硫細菌、綠色硫細菌及紫色非硫菌的某些種),當硫化物消耗殆盡時,光合細菌將沉積于細胞內外的單質硫進一步氧化成硫酸鹽。
光合細菌的種類繁多,但只有紫色硫細菌和綠色硫細菌等一些菌種能代謝硫化物。紫色非硫細菌只有極少數能忍受并利用較高濃度的硫化物。
在厭氧光照條件下,光合細菌以H2S為供氫體,還原CO2合成菌體細胞,而H2S被氧化成S0或進一步氧化成硫酸。光合細菌的脫硫反應可表示為
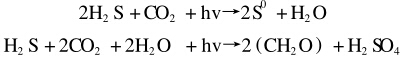
在綠色硫和紫色硫科的細菌中,硫化物首先氧化成S0,其氧化反應S2-→S0,是非酶反應,極易進行。紫色硫細菌在進行H2S→S0反應的同時,也進行S0→SO42-的反應。后者反應很慢,在反應過程中生成的硫粒蓄積在細胞內,而綠色硫細菌在H2S存在的情況下,只能進行H2S→S0反應。生成的硫粒附著在細胞外,使廢水變渾濁,降低了水的透光率,從而影響脫硫效率。另外,光合細菌處理負荷偏低,水力停留時間長,要求光照與厭氧等苛刻條件,研究進展不大,仍處于分批試驗或實驗室小試的探索階段。今后主要的工作應是光合脫硫反應器的研制、提高光合脫硫的效率、控制光照強度以及解決單質硫的分離等問題。
2.2無色硫細菌
無色硫細菌包括嚴格化能自養菌及化能異養菌,也有一些過渡類型。該類細菌僅是一個生理學上的泛稱,而非分類學上的術語,包括貝氏硫菌和硫桿菌屬等。它們能夠氧化硫化氫、元素硫、硫代硫酸鹽和四硫酸鹽等,形成硫酸,并從此過程中獲得能量。

我國對無色硫細菌研究較多,如方士[4]等人進行了生物塔外曝氣法去除沼氣中H2S的研究,得出的最高脫硫率為98.6%。王愛杰[5]等利用脫氮硫桿菌對廢水中的氮和硫進行同步脫除,指出硫氮比和硫化物濃度是同步脫氮脫硫技術的主要因素,兩者分別控制在5∶3和低于300mg/L的水平可以獲得較好的脫硫和反硝化效果,單質硫轉化率最高可達94%;李亞新[6]等利用無色硫細菌進行了硫化氫的脫除試驗,并且對脫硫后生成的單質硫進行了回收,表明反應器內的溶解氧值與進水硫化物的容積負荷呈線性關系,出水pH值和出水pH值的升高值與硫的回收率呈線性關系。在無色硫細菌的微生物類群中,并非所有的硫細菌都能夠用于硫化物氧化。由于有些硫細菌將產生的硫積累于細胞內部,此外雜菌生長還會造成反應器中的污泥膨脹,給單質硫的分離帶來麻煩。如果不能及時得到分離,就會存在進一步氧化的問題,從而影響脫硫效率,所以在脫硫單元運行的過程中,還必須嚴格控制反應條件,以控制這類微生物的優勢生長。
3結論與展望
傳統方法脫硫沼氣有其不足,而微生物脫硫條件溫和、能耗低、投資少且廢物排放少,特別適合處理中低含硫沼氣,因此逐漸成為脫硫領域研究的新熱點。
從脫硫設備及工藝來看,目前生物脫硫多停留在實驗室研究階段,要想獲得大規模應用,還需要在脫硫菌種、生物反應器及脫硫工藝方面進行努力。對現今已發現的硫化物氧化菌進行詳細的生理生化研究,篩選可用于H2S生物脫除的高效菌種;利用現代生物技術工具分離與鑒定硫氧化的相關基因或功能基因,構建新型高效菌種;結合生物技術與化學工程技術開發高效、連續流與脫硫效果穩定的生物反應器,并優化工藝過程,為進一步工業化提供技術支撐。
參考文獻:
[1]許寧,朱延美,馮文華.脫除沼氣中硫化氫的吸收劑改進[J].中國沼氣,2004,22(1):35-37.
[2]胡偉,湯玉珍.沼氣工程中的CO2脫除和回收利用研究[J].中國沼氣,1993.11(3):22-25.
[3]牛克勝,孫嚴聲.沼氣干罰脫硫連續再生工藝綜述[J].中國沼氣,2003,21(1):26-27.
[4]方士,陳國喜,吳玉祥,等.生物塔外曝氣法去除沼氣中H2S的研究[J].浙江大學學報,2000,26(1):46-50.
[5]王愛杰,杜大仲,任南琪,等.脫氮硫桿菌在廢水脫硫、脫氮處理工藝中的應用[J].哈爾濱工業大學學報,2004,36(4):423-429.
[6]李亞新,儲匯林,池勇志.無色硫細菌氧化SRB還原硫酸鹽產品硫化氫生成單質硫[J].城市環境與城市生態,2002,15(5):4-7. |
